- 首页
- 关于我们
-
产品中心
- 光片显微镜系列
- LS-COMPACT光片显微镜 LS18平铺光片显微镜 锘海组织透明化底透台 动植物组织透明化试剂 主动式组织透明化/染色系统 SHIELD 透明化试剂 AMIRA三维视图和分析软件
- 透明化试剂盒&耗材
- 皮肤透明化试剂盒 Lectin血管标记物 组织透明化试剂盒(亲水型) 组织膨胀试剂盒 组织切片透明&膨胀试剂盒(试用装) 胚胎透明化试剂盒 增强型组织透明化试剂盒 细胞膨胀试剂盒
- 组织透明化及成像服务
- 一站式科研服务——组织透明化、免疫染色、3D成像、数据分析及存储
- 小动物活体成像
- 小动物近红外二区成像 PhotoSound小动物活体荧光成像
- 纳米药物制备系统/服务
- 微流控纳米药物递送平台 纳米药物载体合成服务
- 生物3D打印设备
- RegenHU生物3D打印机
- 试剂耗材
- GATTA 显微镜纳米标尺 RISystem小鼠骨钉 Cellendes细胞水凝胶
- 内窥拉曼系统
- 高信噪比内窥拉曼系统
- 小动物灌注设备及附件
- 蠕动泵及附件(NH1000)
- 循环肿瘤细胞捕获计数平台
- ISET循环肿瘤细胞捕获仪
- 类器官3D细胞培养
- 锘海类器官、3D细胞培养系统
-
应用案例
- 成像视频
- 成像视频
- 成像图片
- 成像图片
- 新闻资讯
- 联系我们
光片技术小课堂——光片显微镜的实现
发布日期:2020/6/11 16:45:47
上一次锘海光片技术小课堂简单介绍了光片显微镜的基本结构与原理以及光片显微镜的优势,这次将会继续介绍光片显微镜的实现。
光片显微镜的实现
光片显微镜的基本光学布局与传统显微镜有很大不同,但它相对来说更加直接。检测路径大致与宽场荧光显微镜相同:检测物镜收集从其焦平面射出并通过滤光片的光,然后管透镜再将光投射到相机芯片上。由于不需要在检测路径中引入激发光,所以不需要二色镜。不寻常的是照明路径与检测路径正交,主要由相干光源和光学元件组成的照明路径形成光片并通过照明透镜将其投射到样本上。
与复合显微镜会以直立或倒置等不同方式构建相同,光片显微镜也有多种实现方式。理想情况下,显微镜是围绕样本而建,提供尽可能好的图像质量和必要的空间与时间分辨率,同时在实验期间尽可能将样本保持在理想条件下。因此,基于目标样本的不同,光片显微镜之间也会出现很大的差别,尽管它们仍然具有相同的基本原理。
1、光片的特性
对显微镜性能至关重要的是光片的特性,比如光片的厚度、均匀性和穿透散射组织的能力。理想情况下,如果一片光只照亮检测物镜的焦平面,就会得到一个非常薄的光学切面,同时该光片尽可能薄且能均匀穿过整个视野范围。然而,衍射定律支配着光片的尺寸和光片的在整个视场中的厚度变化(图2-1)。另外,照明物镜的NA也需要仔细选择,以生成一个能穿过整个视野且足够薄的光片。由于衍射极限导致的光片形状限制,通常可以在小视场(约60 μm)的薄光片(约1 μm)(图2-1A)和大视场(约600 μm)的厚光片(约6 μm)(图2-1B)之间进行选择。
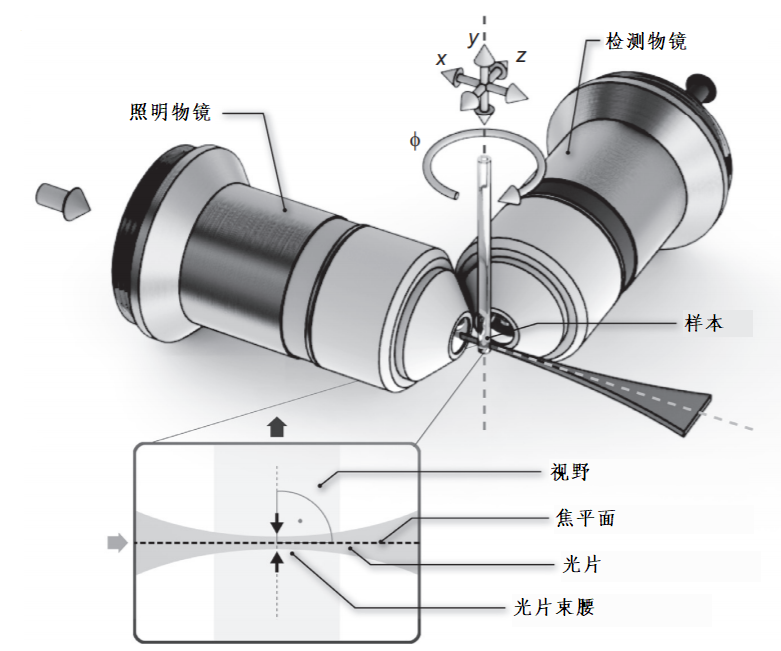
图 2-1 光片的特性与生成(A)薄薄的光片只能在小范围内产生均匀的光照;(B)相比之下,只有较厚的光片才能获得较大的视野;(C)光片可以由圆柱形透镜一维聚焦激光束(静态光片)或通过快速扫描激光束穿过视场(扫描光片)生成。
2、如何生成光片
从根本上讲,光片显微镜可以区分为两种类型(图2-2C):
(1) 使用静态光片(通常由圆柱形光学元件生成)的显微镜;
(2) 使用快速上下扫描光束所生成光片的显微镜。
与圆柱形透镜相比,扫描镜具有更大的灵活性。通过改变扫描振幅可以调整光片的高度,通过改变入射光束的直径可以改变光片的厚度。此外,扫描形成的光片强度均匀,并且可以集成贝塞尔光束、结构照明、双光子激发、共焦线检测等特殊技术。另一方面,通过圆柱形透镜形成光片由于不需要可移动的部件所以易于集成到光路结构中。在使用静态光片时整个视野可以同时被照亮,从而使每条线的功率大大降低并且可以不受扫描镜速度的限制获得更高的速度,而仅受相机速度的限制。
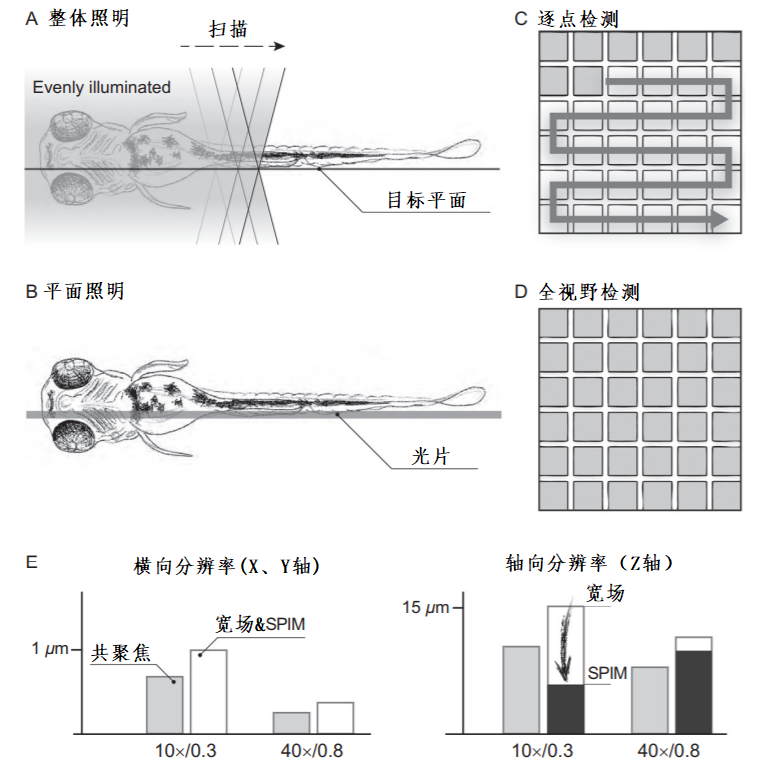
图2-2光片显微镜的实现和多透镜装置的优点 光片显微镜是围绕样本搭建的,因此有许多实现方式:(A)一种基本的SPIM配置,一个物镜用于照明,一个物镜用于检测,样本在样本仓中垂直放置;(B)在基本配置中添加了第二照明物镜;(C)具有两个垂直照明臂和低倍物镜的显微镜,成像室通常与光学元件隔离,以便在成像液中更好地固定大样本;(D)具有第二检测物镜的配置可用于同时从两侧获取图像;(E)一种特殊的45°物镜结构(iSPIM),用于使用光片显微镜观察载玻片样本;(F)用单侧照明获得的光片图像数据会因折射、散射和吸收而产生图像失真;(G)双侧照明(如在B、C和D中)可以通过将图像的两个照明效果更好的部分合并为一个来避免这种失真。
3、垂直与水平排布
为了实现两条光路的正交光学排布,通常在水平方向上配置光片显微镜,同时样本从上方悬挂在照明和检测路径的交叉处(如上一篇图1-1,图2-2A等)。垂直放置样本的优势是方便旋转样本,能从多个角度对其进行成像。另一种选择是在垂直方向配置光片显微镜,照明路径通常在水平方向而检测路径通常在上方进行检测(如图2-2C等),这样的光路配置使得在使用扫描(虚拟)光片配置时可以更方便地校准调试光路。在垂直方向配置下,样本可以水平放置在两条光路的交叉处,虽然这样的方式不适合旋转样本,但是在其他方面的优势更明显。首先是水平放置样本时可以免去重力对样本的拉伸变形,其次由于垂直配置下对样本进行的位移都是沿轴向且均一的,可以防止由于在旋转样本时施加在样本上的扭矩而产生的形变,这样在后期进行数据拼合时更不容易出现错位偏差和信号损失等情况。进一步说,除去样本检测过程中可能出现的变形的影响,水平配置光路悬挂旋转样本的方式由于在后期进行数据拼合时也是从各个方向进行拼合,使得最后样本结果的分辨率不均一,从而导致整体分辨率大打折扣。
4、围绕样本搭建显微镜
与其他技术相比,光片显微镜可以更快、更有效地对固定的、透明的样本进行成像,并且光片显微镜在活体样本成像方面也具有先天的优势:大大降低的光毒性,结合快速采集和灵活的样本定位,是对细胞群、组织样本或整个动物快速发育过程的理想成像工具。为了给这些特定的成像任务提供好的环境条件,一些光片显微镜配备可盛放成像液的成像仓和水浸的照明和检测物镜(图2-2A)。结合水性的样本,可以实现折射率匹配的光路。可盛放成像液的成像仓也为成像环境的控制及成像时的养分或药物供给提供方便。
样本的一些不利光学特性会对光产生吸收、散射和折射,从而限制光片的穿透深度使其变宽并改变位置(图2-2F)。这样采集到的图像可能出现模糊、不聚焦或有明暗条纹等现象。在这种情况下,额外的照明路径(三透镜配置)可以提高图像质量(图2-2B)。其光学结构通常与第一条照明路径相同,并通过额外的照明物镜从另一侧照亮样本。由两条照明路径产生的光片照亮同一平面,即检测物镜的焦平面。两条照明路径通常可以交替单独打开,然后可以拼合来自两个照明侧的图像中照明良好的部分,从而得到质量均匀的最终图像(图2-2G)。双侧照明可以改善固定且透明标本的整体荧光激发。对于此类样品,选择的检测路径大多是垂直的(图2-2C)。
5、物镜
对于照明和检测物镜的选择是决定光片显微镜光学性能的关键。一般来说,在使用盛放成像液的成像仓时,空气物镜由于其使用上的广泛性,通常都会选择。但想要配置高放大率的检测物镜通常伴随着高NA和低工作距离,这就导致必须配置介质镜。但是,通常情况下,照明和检测路径的正交方向限制了物镜的选择。高NA的探测物镜通常太大,无法与另一个正交放置的介质镜组合。因此,在大多数情况下,空气物镜是更好的选择。幸运的是,在照明路径不需要高NA物镜,一个简单的10×/0.3透镜就足以产生厚度只有几微米的光片。
参考文献:
1.Engelbrecht, C. J., &Stelzer, E. H. (2006). Resolution enhancement in a light-sheet-based microscope(SPIM). Optics Letters, 31(10), 1477–1479.
2. Huisken, J., Swoger, J., DelBene, F., Wittbrodt, J., & Stelzer, E. H. K. (2004). Optical sectioningdeep inside live embryos by selective plane illumination microscopy. Science,305(5686), 1007–1009.
3. Keller, P. J., Schmidt, A. D.,Wittbrodt, J., & Stelzer, E. H. K. (2008). Reconstruction of zebrafishearly embryonic development by scanned light sheet microscopy. Science, 322(5904),1065–1069. http://dx.doi.org/10.1126/science.1162493.
4. Planchon, T. A., Gao, L.,Milkie, D. E., Davidson, M. W., Galbraith, J. A., Galbraith, C. G., et al.(2011). Rapid three-dimensional isotropic imaging of living cells using Besselbeam plane illumination. Nature Methods, 8(5), 417–423.http://dx.doi.org/10.1038/nmeth.1586.
5. Breuninger, T., Greger, K.,& Stelzer, E. H. K. (2007). Lateral modulation boosts image quality insingle plane illumination fluorescence microscopy. Optics Letters, 32(13), 1938–1940.
6. Keller, P. J., Schmidt, A. D.,Santella, A., Khairy, K., Bao, Z., Wittbrodt, J., et al. (2010). Fast, high-contrastimaging of animal development with scanned light sheet-based structuredilluminationmicroscopy. Nature Methods, 7(8), 637–642. http://dx.doi.org/10.1038/nmeth.1476.
7. Truong, T. V., Supatto, W.,Koos, D. S., Choi, J. M., & Fraser, S. E. (2011). Deep and fast live imagingwith two-photon scanned light-sheet microscopy. Nature Methods, 8(9), 757–760. http://dx.doi.org/10.1038/nmeth.1652.
8. Baumgart, E., &Kubitscheck, U. (2012). Scanned light sheet microscopy with confocal slit detection.Optics Express, 20(19), 21805–21814.
9. Fahrbach, F. O., Gurchenkov,V., Alessandri, K., Nassoy, P., & Rohrbach, A. (2013). Selfreconstructingsectioned Bessel beams offer submicron optical sectioning for large fields ofview in light-sheet microscopy. Optics Express, 21(9), 11425. http://dx.doi.org/10.1364/OE.21.011425.
10. Swoger, J., Verveer, P.,Greger, K., Huisken, J., & Stelzer, E. H. K. (2007). Multi-view image fusionimproves resolution in three-dimensional microscopy. Optics Express, 15(13), 8029–8042.
11. Huisken, J., & Stainier,D. Y. R. (2007). Even fluorescence excitation by multidirectional selectiveplane illumination microscopy (mSPIM). Optics Letters, 32(17), 2608–2610.
12. Dodt, H.-U., Leischner, U.,Schierloh, A., Ja¨hrling, N., Mauch, C. P., Deininger, K., et al. (2007).Ultramicroscopy: Three-dimensional visualization of neuronal networks in the wholemouse brain. Nature Methods, 4(4), 331–336. http://dx.doi.org/10.1038/nmeth1036.
13. Ermolayev, V., Friedrich, M.,Nozadze, R., Cathomen, T., Klein, M. A., Harms, G. S., et al.(2009). Ultramicroscopy revealsaxonal transport impairments in cortical motor neurons at prion disease.Biophysical Journal, 96(8), 3390–3398. http://dx.doi.org/10.1016/j.bpj.2009.01.032.14.Ja¨hrling, N., Becker, K., & Dodt, H.-U. (2009). 3D-reconstruction of bloodvessels by ultramicroscopy. Organogenesis, 5(4), 227–230.
