注:本文多数内容来自参考文献,文献题为“Lipid Nanoparticles for Drug Delivery”,如需更深入了解,可查阅原文献。原文链接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/anbr.202100109
脂质纳米颗粒(LNP)具有较好的生物相容性、生物降解性以及包埋效率,因此被认为是DNA、mRNA和siRNA等核酸的理想载体。文中作者分多个章节详细的介绍了LNP的制备、表征及应用,接着,小编聚焦要点,重点介绍LNP的表征及其在包封疏水性药物方面的应用。
1.LNP的表征
粒径、ZP及表面形态
LNP的平均粒径多位于100-400nm之间,当通过静脉注射进行系统性给药时,10-150nm的粒径是更为理想的选择。此外,PDI可表明粒径的分布指数,PDI和粒径可使用激光粒度仪同时测定。PDI<0.2,通常可认为粒径分布较窄,实际上,PDI位于0.2-0.3之间,对于部分研究者来说依然可以接受。
ZP是指由ZP分析仪检测的颗粒表面电荷。ZP绝对值大于30mV时,通常可认为粒子足以相互排斥并保持静电稳定。但对于系统性药物递送,建议选择近中性电荷;近中性电荷,弱相互排斥也解释了LNP在放置过程中为何会有粒径的增长。
扫描电子显微镜(SEM)、原子力显微镜(AFM)和透射电子显微镜(TEM)都可以用来观察颗粒表面形态。TEM和SEM分别通过从颗粒内部结构和颗粒表面传输的电子提供形态信息,相比之下,AFM允许获得LNP的3D特性。
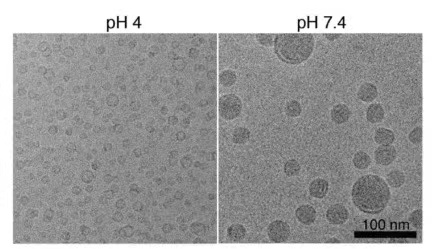
图1.LNP电镜图
包封率(EE)测定
包封率是LNP包裹的重要指标,它表明了有效成分的利用效率。脂质类型、组成、结晶度以及药物溶解度等因素都会影响包封率。而提到结晶度,读者可能会相对陌生,脂质和包封的药物在存储过程中可能会发生多晶型转变,导致药物不稳定或排出,从而影响载药量与药物释放,通常可结合差示扫描量热法(DSC)和X射线衍射(XRD)来测定样品的结晶度。
2.疏水性药物包封
LNP用来包封核酸在之前的系列推文里已有较多介绍,铭汰公司的微流控设备已为广大研究者提供了诸多此类服务。我们知道,核酸为亲水性成分,那么LNP能否用于疏水性药物的包封呢?答案是肯定的。实际上,在研药物中有90%都为疏水性,因此,开发疏水性药物的递送工具势在必行。
LNP已广泛用于疏水性药物递送,例如,多西他赛(DTX)是一种有效的抗肿瘤和抗血管生成剂,由于其水溶性差、细胞毒性高,因此临床应用受到了限制。为解决这些问题,使用Compritol 888 ATO作为脂质材料、Pluronic F127和Span 80作为稳定剂制备了载DTX的LNP。检测表明:LNP的粒径为128nm,PDI为0.2,DTX的EE高达86%,DL为2%,并且还观察到了控释曲线,更令人惊喜的是,载DTX的LNP在120天内都保持了稳定状态。
文中也提到了LNP对其他多种疏水性药物的包封,当然,有些包封并未使用微流控技术,但小编最近接触过的研究者中,确实有使用微流控技术进行中药粉末包封的案例。中药粉末为疏水性药物,将其溶解在乙醇相中,水相使用PBS缓冲液,通过配方调控,最终得到了均一、稳定的纳米粒子。
总结:LNP的表征是包封后必不可少的一步,它实际上是粒子形态的一种量化体现,依据量化参数,我们方能更好地追溯脂质结构与功能之间的关系。而在RNA疫苗火热研究的背景下,微流控技术更多的被聚焦在核酸药物的包封上,事实上,它的应用范围远不止于此。相信随着疏水性药物包封研究的深入推进,微流控技术定能在诸多类型的药物包封中占有更重要的位置。
参考文献:
1. L.Xu, X.Wang, G.Yang, et al., Lipid Nanoparticles for Drug Delivery. Adv. NanoBiomed Res.2022, 2, 2100109.
铭汰Microflow系列微流控纳米药物递送平台
专注于纳米药物制备及递送技术,提供一站式整体解决方案
铭汰Microflow系列微流控纳米药物递送平台Microflow系列纳米药物制备系统基于微流控技术,能使用脂质材料快速包裹有效成分,实现药物稳定递送。可包裹材料有:化药、mRNA、siRNA、DNA等,从低通量至高通量均可覆盖,适用于临床前研究和符合GMP的临床生产,并可在纳米颗粒表面添加标记物制造靶向药物。目前已服务国内多家知名药企并具备成功申报临床的案例。

铭汰Microflow系列微流控纳米药物递送平台,详细信息请点击链接:铭汰Microflow系列微流控纳米药物递送平台



