100多年前德国解剖学家Werner Spalteholz发表了关于生物医学样品进行组织透明化处理的早期报告,成功地观察到透明样品的宏观结构[1]。随着先进的组织透明化方法和3D成像技术的出现方法,科研人员已经能够以细胞到亚细胞的分辨率全方位观察单个器官或组织甚至单个生物体。而收集细胞的相关生物信息需要根据组织结构、细胞类型和细胞活性进行适当的标记[2]。经典的免疫荧光和荧光原位杂交分别标记蛋白质和mRNAs的方法,普遍用于薄组织切片中,荧光结合的大分子在其中可以快速扩散。通常小组织可以很容易地用分子探针(如抗体)染色;然而,就像所有依赖被动扩散的组织处理方法一样,大组织的染色需要更长的孵育时间,因此即使在脱脂或水凝胶包埋后,探针也需要数周或数月才能彻底穿透大样本[3]。
此外,在传统的被动标记方法中,用于标记的实验参数(例如孵育时间、探针量)高度依赖于样品性质(例如组织类型、大小、形状)和靶蛋白性质(例如表达水平、分布模式),因此,每个实验都需要费力、昂贵和耗时的优化。被动标记的结果在许多情况下是高度不均匀的,外部区域标记饱和,核心区域标记较弱甚至没有标记[4]。因此,设计允许抗体(用于免疫荧光)和寡核苷酸(用于原位杂交)渗透到完整器官或同等大小的组织样本中的方法仍然具有挑战性。
为了解决这一局限性,麻省理工Dr. Kwanghun Chung课题组开发了一种称为SHIELD(stabilization under harsh conditions via intramolecular epoxide linkages to prevent degradation)的方法,以保存器官级透明组织中蛋白质的荧光、蛋白质抗原性、转录物和组织结构[5]。SHIELD使用聚环氧化合物通过形成分子内和分子间交联来保护生物分子的物理化学性质(例如,蛋白质荧光和抗原性)。经SHIELD固定和脱脂的组织可以承受苛刻的抗体脱色条件,因此可以对同一样本进行多轮染色和成像。

图1. 2018年SHIELD荣登《Nature Biotechnology》的封面
此外,Dr.Chung课题组发展的一系列技术:为了在不损害组织完整性的前提下加速分子标记,发展了一种新的分子转运模式,称为随机电泳技术(Stochastic electrotransport)[6],可快速将抗体、染料输送到致密的组织凝胶中,并允许在2或3天内对完整的小鼠器官进行均匀的染色(而在依赖被动扩散的方法中,则是数周到数月)。为了确保免疫标记的一致性,采用SWITCH技术在整个样品中同步化学反应。该方法有两个基本步骤[7]:(1)SWITCH-OFF,当化学物质和缓冲液在组织中自由扩散时,化学反应被抑制;(2)SWITCH-ON,当缓冲环境迅速改变到允许化学反应的条件时,就可以启动。以这种方法,组织结构、天然生物分子和抗原性被高度保留,且允许多达≥20轮标记。
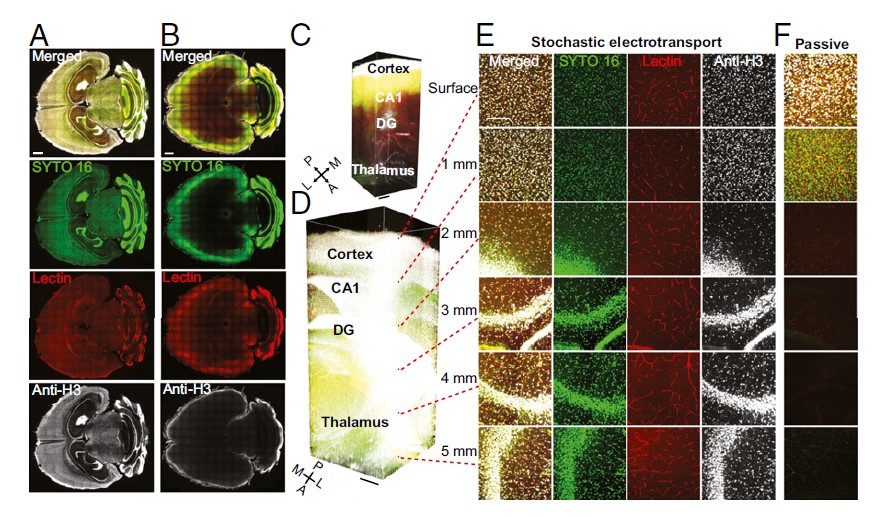
图2. 随机电泳技术展示对完整的大脑进行均匀和完全的染色
(A、E:主动式随机电泳;B、F:被动式)

图3. SWITCH技术展现强大的多轮染色能力
通过结合以上这些强大的技术,LifeCanvas主动式染色仪器SmartLabel(锘海代理)可实现从表面到核心均匀的全器官抗体标记,它的优势还不仅如此:
快速:与被动标记相比,标记完整大组织样本(例如啮齿动物器官)要快一个数量级(≤48小时vs.数周至数月)。
简便:只需加载缓冲液、样品及探针。双样本仓设计,可以同时执行2个不同的标记实验。
高效:使用少量抗体(低至?3 μg)即可标记完整小鼠大脑。
可靠:利用随机电泳技术防止组织损伤。专利的纳米半透膜有效消除组织污染和探针损失。
环境友好型:缓冲液可以安全地排入下水道。

SmartLabel智能荧光标记电泳仪
参考文献
[1] Ueda HR, Dodt HU, OstenP, Economo MN, Chandrashekar J, Keller PJ. Whole-Brain Profiling of Cells andCircuits in Mammals by Tissue Clearing and Light-Sheet Microscopy. Neuron.2020;106(3):369-387.
[2] Susaki EA, Shimizu C, Kuno A, et al.Versatile whole-organ/body staining and imaging based on electrolyte-gelproperties of biological tissues. Nat Commun. 2020;11(1):1982.
[3] Ueda HR, Ertürk A, ChungK, et al. Tissue clearing and its applications in neuroscience [publishedcorrection appears in Nat Rev Neurosci. 2020 May;21(5):298]. Nat RevNeurosci. 2020;21(2):61-79.
[4] Yun D H , Park Y G , Cho J H , et al. Ultrafast immunostaining oforgan-scale tissues for scalable proteomic phenotyping. bioRxiv. 660373.
[5] Park YG, Sohn CH, ChenR, et al. Protection of tissue physicochemical properties using polyfunctionalcrosslinkers. Nat Biotechnol. 2018;10.1038/nbt.4281.
[6]Kim SY, Cho JH, Murray E, et al. Stochastic electrotransport selectivelyenhances the transport of highly electromobile molecules. Proc NatlAcad Sci U S A. 2015;112(46):E6274-E6283.
[7] Murray E, Cho JH, Goodwin D, et al. Simple,Scalable Proteomic Imaging for High-Dimensional Profiling of IntactSystems. Cell. 2015;163(6):1500-1514.





